Forschungsüberblick
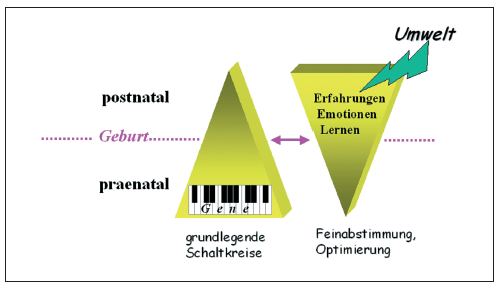
 Lernen in der Kindheit und Jugend unterscheidet sich vom Lernen bei Erwachsenen darin, dass emotionale Erfahrungen und Lernprozesse dazu genutzt werden, die bei der Geburt noch unreifen funktionellen Schaltkreise des Gehirns, insbesondere der präfronto-limbischen Schaltkreise zu optimieren. Diese evolutionsgeschichtlich alten Entwicklungsprinzipien, die bei Säugetieren, einschließlich dem Menschen, zu beobachten sind, kann man bildhaft mit der Formatierung der "Festplatte" Gehirn vergleichen. Über erfahrungs- und lerninduzierte neuronale Optimierungsprozesse werden in der "Hardware" - dem Gehirn- schon in der frühesten Kindheit prinzipielle Konzepte, Denk- und Verhaltensstrategien, und auch für die mit jedem assoziativen Lernprozess untrennbar verknüpfte emotionale Erlebniswelt angelegt. Auf den Menschen bezogen bedeutet dies, daß die frühkindliche soziale, emotionale und intellektuelle Förderung und vermutlich auch die ethisch-moralische Erziehung in der frühen Kindheit gehirnorganische Spuren hinterläßt, die lebenslang erhalten bleiben.
Lernen in der Kindheit und Jugend unterscheidet sich vom Lernen bei Erwachsenen darin, dass emotionale Erfahrungen und Lernprozesse dazu genutzt werden, die bei der Geburt noch unreifen funktionellen Schaltkreise des Gehirns, insbesondere der präfronto-limbischen Schaltkreise zu optimieren. Diese evolutionsgeschichtlich alten Entwicklungsprinzipien, die bei Säugetieren, einschließlich dem Menschen, zu beobachten sind, kann man bildhaft mit der Formatierung der "Festplatte" Gehirn vergleichen. Über erfahrungs- und lerninduzierte neuronale Optimierungsprozesse werden in der "Hardware" - dem Gehirn- schon in der frühesten Kindheit prinzipielle Konzepte, Denk- und Verhaltensstrategien, und auch für die mit jedem assoziativen Lernprozess untrennbar verknüpfte emotionale Erlebniswelt angelegt. Auf den Menschen bezogen bedeutet dies, daß die frühkindliche soziale, emotionale und intellektuelle Förderung und vermutlich auch die ethisch-moralische Erziehung in der frühen Kindheit gehirnorganische Spuren hinterläßt, die lebenslang erhalten bleiben.
Wie alles beginnt...
Die erste emotionale Erfahrung des neugeborenen (Tier-)Kindes ist die Interaktion mit seinem Eltern. Verhaltensstudien an Nagern und Affen, und Studien am Menschen haben gezeigt, dass die Intensität sozialer und emotionaler Erfahrung während der frühen Kindheit mit der/den Bezugsperson(en) von kritischer Bedeutung für eine normale intellektuelle und emotionale Entwicklung ist. Sowohl tierexperimentelle Forschung als auch die Ergebnisse klinischer Untersuchungen, beispielsweise Adoptionsstudien an Waisenkindern, weisen darauf hin, daß sich der Entzug von emotionaler Erfahrung (Vernachlässigung, Deprivation), oder auch traumatische Erlebnisse in der Kindheit, negativ auf die Entwicklung geistiger und emotionaler Kompetenzen auswirken. Emotionale Vernachlässigung, Misshandlung und Traumatisierung in früher Kindheit erhöht das Risiko, im späteren Leben psychische Störungen zu entwickeln, wie z.B. Depression, Phobien, Zwangsstörungen, Aufmerksamkeits- und Hyperaktivitätsstörungen (ADHS).
Welche gehirnbiologischen Veränderungen liegen dieser Anpassungsfähigkeit aber auch der Vulnerabilität des kindlichen Gehirns und deren Langzeitfolgen zugrunde? Wir untersuchen diese Frage in Kooperation mit Psychiatern, Psychologen und Biologen und wollen Fragen beantworten wie: Wie wirkt sich Stress im Mutterleib auf die Entwicklung von Gehirn und Verhalten aus? Hat Stress und Traumatisierung vor der Schwangerschaft einen Einfluß auf die Gehirnentwicklung (ja!) und welche Mechanismen liegen dieser transgenerationalen Weitergabe des Traumas zugrunde? Unterscheiden sich männliche und weibliche Nachkommen hinsichtlich ihrer Vulnerabilität gegenber Stress, Traumatisierung und Vernachlässigung (ja!)? Über welche Schutzmechanismen vefügen Individuen, die trotz negativer Kindheitserlebnisse keine psychischen Störungen entwickeln (Resilienz)? Nur über ein detailliertes Wissen dieser Entwicklungsprozesse wird es zukünftig möglich sein, gezielte und maßgeschneiderte Strategien zur Prävention und Therapie zu entwickeln.
Das TRANS-Gen Projekt:
- Meine Kindheit - Deine Kindheit
- Das UBICA Projekt
Was wir wissen...
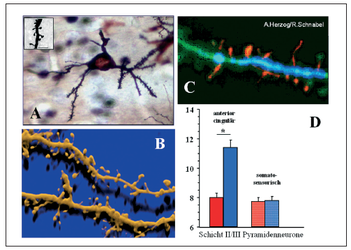
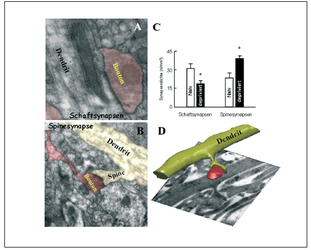
Unsere tierexperimentellen Untersuchungen zeigen, daß Stresserfahrung vor oder kurz nach der Geburt (z.B. eine Unterbrechung des Kind-Eltern Kontaktes) zu dauerhaften synaptischen und dendritischen Veränderungen in den Gehirnregionen führt, die sowohl für emotionales Verhalten, als auch für Lern- und Gedächtnisfunktionen essentiell sind (präfrontaler Cortex, limbisches System). Diese gehirnbiologischen Veränderungen liegen höchstwahrscheinlich den Verhaltensveränderungen zugrunde, die diese Tiere zeigen, und wir vermuten, daß ähnliche neuronalen Veränderungen beim Menschen im Verlauf der Kindheit oder bereits vor der Geburt für die Entstehung psychischer Störungen verantwortlich sind.
Das kindliche Gehirn unter Stress
Mit bildgebenden Verfahren konnten wir an Strauchratten (Octodon degus) zeigen,


Degu Familie mit Jungen
Abb. Strauchratte
Degu Juntiere
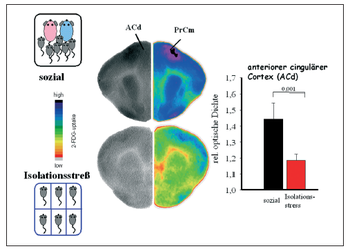
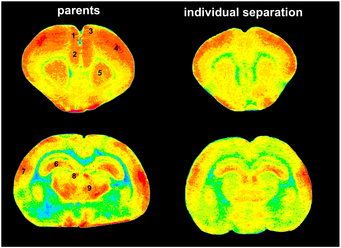
dass die Aktivität vieler Areale des kindlichen Gehirns, insbesondere die präfrontalen und limbischen Zentren unter akutem Stress stark abnimmt:
Darüber hinaus konnten wir zeigen, daß diese akut durch das Stresserleben gedrosselte Gehirnaktivität bei wiederholter Stresserfahrung chronisch wird, d.h. Stresserfahrung über einen längeren Zeitraum hinweg führt zu einer chronischen Unterfunktion im Gehirn, insbesondere im Präfrontalcortex, ein Bereich der beispielsweise bei ADHS Kindern eine Unterfunktion aufweist.
Die Rolle des Vaters
Während die Bedeutung der mütterlichen Fürsorge auf die Entwicklung von Gehirn und Verhalten auch tierexperimentell bereits recht gut untersucht ist, sind Studien zur Bedeutung der väterlichen Fürsorge für die Gehirnentwicklung noch sehr spärlich. In Kooperation mit Prof. R. Feldman, BarIlan University, Israel untersuchen wir menschliche Väter und Strauchratten-Väter, um herauzufinden, welchen Einfluß die väterliche Fürsorge auf die funktionelle Reifung präfrontaler und limbischer Schaltkreise ihrer Nachkommen hat, und ob das Fehlen väterlicher Fürsorge zu einer Verzögerung oder Fehlentwicklung der Funktion dieser kognitiv und emotional bedeutenden Gehirnareale führt. Deguväter beteiligen sich während der ersten Lebenswochen intensiv an der Pflege und Aufzucht ihrer Jungen, die Interaktion zwischen den Deguvätern und ihren Jungen beinhaltet vielfältige Körperkontakte wie Kuscheln, Schmusen, gegenseitige Körperpflege und Spielen. Damit liefert der Vater seinen Nachkommen ein reichhaltiges sensorisches und vor allem auch ein komplexes sozio-emotionales Umfeld.
Wie entwickelt sich das Gehirn von vaterlosen Tieren im Vergleich zu Tieren die von beiden Eltern betreut wurden? Wir konnten zeigen, daß die fehlende Anregung durch den Vater die vollständige Ausreifung von synaptischen Netzwerken stark beeinträchtig, insbesondere in Hirnregionen, die für eine normale Verhaltensentwicklung essentiell sind. Vaterlos aufgewachsene Jungtiere besitzen beispielsweise im orbitofrontalen Cortex (OFC), einer Hirnregion die für die Steuerung emotionaler Verhaltensweisen u.a. auch Aggressionsverhalten bedeutsam ist, weniger Spine-Synapsen (Helmeke et al 2009), eine dauerhafte Veränderung, die auch im erwachsenen Tier noch nachweisbar ist. Eine geringere Dichte solcher erregend wirkenden Spinesynapsen im OFC vaterdeprivierter Tiere könnte daher einerseits darauf hinweisen, dass diese Region des präfrontalen Cortex nicht ausreichend aktivierbar ist, und darüber hinaus könnte ein Mangel an solchen plastischen Spinesynapsen vermuten lassen, dass die Tiere im Verlauf ihre Lebens emotionale, soziale und kognitive Defizite entwickeln.
Aber auch das Gehirn der Väter hat sich verändert. Mit bildgebenden Verfahren konnten wir an männlichen Degus nachweisen, daß die Verhaltensreaktion (Hinwendung) auf kindliche Verlassenheitsrufe bei Vätern sehr viel stärker ist als bei gleichaltrigen “Junggesellen” und daß die damit einhergehende Gehirnaktivierung bei Deguvätern dramatisch ansteigt wenn sie die Kinderlaute hören, während dies bei Junggesellen sehr viel niedriger ist.
Was steckt dahinter?
Die Entwicklung von Gehirn und Verhalten vollzieht sich in einem Wechselspiel zwischen genetisch determinierten Faktoren und der Umwelt, über die "epigenetische“ Veränderungen induziert werden können.
Epigenetische Veränderungen sind transiente oder stabile (transgenerational vererbbare!) Veränderungen der Genexpression, die nicht in der DNA-Sequenz selbst kodiert sind. Auf molekularer Ebene umfassen epigenetische Veränderungen direkte Modifikationen der DNA durch DNA-Methylierung und spezifische Modifikationen von Histon-Proteinen (wichtigen Bestandteilen des Chromatins) durch z. B. Acetylierung, Methylierung, Phosphorylierung u.a.. Während beispielsweise Acetylierung und Phosphorylierung von Histonen im Allgemeinen zu einer Erhöhung der Genexpression führen, hat eine erhöhte Methylierung bestimmter Genorte der DNA eine Reduktion bzw. Inhibition der Genexpression zur Folge.
Anhand verschiedener Tiermodelle untersuchen wir den Einfluss perinataler emotionaler Erfahrungen (prä- bzw. postnataler Stress, soziale Deprivation) und von frühkindlichen Lernprozessen auf die funktionelle Reifung des Gehirns und auf die Verhaltensentwicklung. Unser Ziel ist es, die umweltinduzierten zellulären (neuralen und glialen), strukturellen Reorganisationsprozesse ebenso wie die neurochemischen Veränderungen innerhalb der präfrontalen-limbischen Schaltkreise zu identifizieren und zu charakterisieren. Darüber hinaus wollen wir die epigenetischen Mechanismen aufklären, die die molekulare Grundlage für die hier skizzierten neuronalen und synaptischen Reorganisations- und Optimierungsprozesse darstellen. Schließlich gehen wir der Frage nach, warum frühe Traumatisierung, Vernachlässigung und Mißhandlung transgenerational weitergegeben werden, Die aus solchen tierexperimentellen Ansätzen gewonnenen Erkenntnisse können einerseits dazu beitragen, die Entstehung von umweltinduzierten Verhaltens- und Lernstörungen besser zu verstehen und vor allem diese frühzeitig zu verhindern und andererseits auch in die Entwicklung neuer pädagogischer Konzepte im Vorschulbereich einfließen.